皆さん、こんにちは。草原の探求者、キツネ博士じゃ。
本日は、クローン病(Crohn’s Disease: CD)における重篤な合併症「腸管線維化」のメカニズムに迫る、非常に興味深い学術論文(Bauer-Rowe et al., Cell, 2025)について、少し専門的な視点から深掘りして解説しようと思う。生物学や医学に興味を持つ学生さんや、医療関係者の方々にも楽しんでいただけると幸いじゃ。
序論:クローン病と残された謎「クリーピングファット」
クローン病は、消化管に全層性の慢性炎症を引き起こす炎症性腸疾患(IBD)の一種 。この持続的な炎症は、組織の修復応答を異常に活性化させ、結果として細胞外マトリックス(Extracellular Matrix: ECM)が過剰に蓄積する「線維化」を誘導する。これにより腸管壁が肥厚・硬化し、内腔が狭まる「狭窄」が形成され、多くの患者さんを苦しることなるのじゃ 。
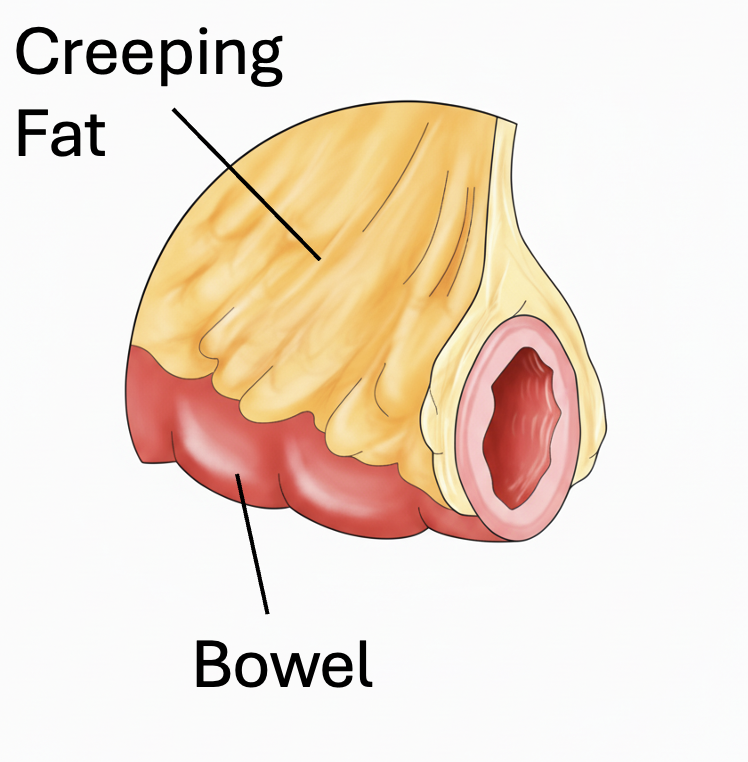
臨床現場では、CDの病変部には「クリーピングファット(Creeping Fat: CF)」と呼ばれる腸間膜脂肪組織が特徴的に巻き付いていることが古くから知られておる 。しかし、このCFが単なる炎症の結果なのか、それとも線維化のプロセスに積極的に関与しているのかは、長らく不明確なままであったんじゃ。
今回の研究は、「CFに由来する特定の線維芽細胞集団が、メカノセンシティブな性質を介して腸管線維化を駆動しているのではないか」という画期的な仮説を検証したもので、多角的なアプローチでその謎に挑んだ報告になる 。
ヒト組織解析:CD線維芽細胞アトラスが明らかにした病原性細胞
まず、どんな奴らが悪さをするのかを、犯人を探すことからからじゃな。
研究チームは、ヒトのCD患者から得られた組織を用い、その細胞多様性を解き明かすことから始めた。彼らは、既存の公開データと自身で取得したデータを統合し、426人の患者由来、約180万個の細胞からなる大規模なシングルセルRNAシーケンシング(scRNA-seq)メタ解析を実施し 。これにより、かつてない解像度で「ヒトCD線維芽細胞アトラス」を構築したのじゃな。
この網羅的なアトラスを解析した結果、極めて重要な発見があった。それは、
CTHRC1(Collagen Triple Helix Repeat Containing 1)という遺伝子を強く発現する線維芽細胞集団が、CD患者の狭窄部、とりわけCFにおいて著しく増加しているという事実じゃ 。
さらに、このCTHRC1+線維芽細胞の遺伝子発現プロファイルを詳細に解析すると、以下の特徴が浮かび上がってきた。
- 高いECM産生能: コラーゲンをはじめとする多数のECM関連遺伝子の発現が、他のどの線維芽細胞集団よりも高かったんじゃ 。プロファイブロティックな性質とも言える。
- メカノシグナルの活性化: 細胞が物理的な硬さや張力を感知し、応答するためのシグナル伝達経路である
YAP/TAZ経路が、この細胞集団で顕著に活性化していた 。
これらの結果は、
CTHRC1+線維芽細胞が、線維化を強力に推進する「プロファイブロティック」な性質と、周囲の物理環境に応答する「メカノセンシティブ」な性質を併せ持つ、病態の鍵となる細胞集団であることを強く示唆しておったんじゃ 。
空間的解析:線維化ニッチにおけるCTHRC1+細胞の局在
次に、このCTHRC1+線維芽細胞が組織内のどこに存在するのか、その「アジト」を特定する必要があった。
そこで、空間トランスクリプトミクス技術(VisiumおよびXenium)が用いられた 。
scRNA-seqと空間トランスクプトミクス技術の違い
- scRNA-seq:組織を破砕して、一細胞レベルにまで細かくした状態で細胞ごとの遺伝子発現をみる
- 空間トランスクプトミクス:組織のまま、遺伝子発現を見る(遺伝子発現が組織のどこで起きているのか特定することができる)
解析の結果、CFと腸壁(Bowel Wall: BW)が接する「インターフェース(Interface: IF)」と呼ばれる領域が、ECMの超微細構造解析においても極めて線維化が進行した「ニッチ」を形成していることが明らかになった 。
ここイラスト
そして、CTHRC1+線維芽細胞は、まさにこの線維化インターフェースに選択的に集積していることが突き止められたんじゃ 。この発見は、CTHRC1+細胞が線維化の最前線で活動していることを示しておる。
機能的証明:新規マウスモデルが実証した「外からの侵入」とYAP/TAZの役割
ヒトでの観察結果を機能的に証明するためにはマウスモデルが必須じゃ。そこで研究チームはCFと腸管線維化を再現する新規の結腸切開マウスモデル(Colotomyモデル)を開発した。このモデルを使うことで、彼らはCFの役割を直接的に検証したんじゃ。
圧巻だったのは、
局所的な細胞系譜解析じゃ。
細胞系譜解析
ある特別なマウス(目的細胞マーカー遺伝子-CreERT2マウス)に、薬剤(4-ヒドロキシタモキシフェン)を投与すると、目的の細胞がだけが蛍光を発するようになる。その光った細胞の移動を観察する技術じゃ。今回著者らが活用したのは線維芽細胞で発現の高いCol1a2のマウス(–Col1a2CreERT2マウス)。
*デメリット:投与した薬剤は基本的に全身にわたるんじゃ、そのため「この部位の細胞だけ光らせたい」という希望をかなえることはできなかった。
しかし著者らは、局所的な細胞系譜解析を可能としたのじゃ!
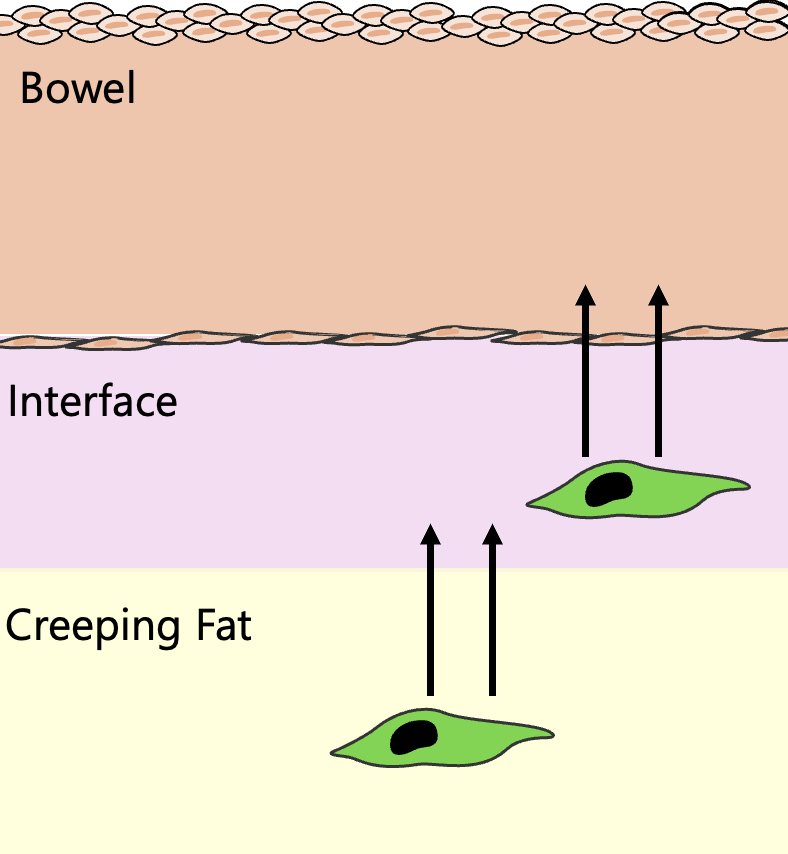
薬剤(4-ヒドロキシタモキシフェン)をリポソームに封入して腸間膜に局所投与すると、薬剤はCFにのみ留まることを見せた!つまり、投与された薬剤によって光る線維芽細胞はCFとインターフェイスにいる線維芽細胞のみ!腸管の線維芽細胞は光らせずに、CFの線維芽細胞のみを光らせることに成功したのじゃ。
これによって
光ったCFの線維芽細胞が、腸壁の線維化部位へと遊走・浸潤していく様子が明確に捉えられたんじゃ 。これは、CFが線維化細胞の「供給源」であることを直接的に証明する、動かぬ証拠となった。
最後に、
YAP/TAZシグナルの重要性を検証するため、CF由来の線維芽細胞で特異的にYAPとTAZを遺伝子レベルでノックアウト(KO)した。すると、KOマウスではCF由来線維芽細胞の腸壁への遊走が著しく阻害され、腸壁の肥厚やECM沈着といった線維化が有意に軽減されたんじゃ 。
結論と臨床的意義:治療戦略のパラダイムシフトへ
本研究は、CDにおける腸管線維化の病態理解を大きく前進させた。結論として、
CFは単なる炎症の bystander(傍観者)ではなく、YAP/TAZシグナルに依存して活性化されたプロファイブロティックなCTHRC1+線維芽細胞を腸壁へ供給することで、線維化を「外から内へ(outside-in)」と積極的に駆動する、病態の主役であったことが明らかになったんじゃ 。
この発見は、将来の治療戦略に新たな道を示すものじゃ。従来の抗炎症療法では制御が困難であった線維化に対し、
CFそのものや、CTHRC1+線維芽細胞、あるいはその活性化を司るYAP/TAZ経路を標的とすることで、全く新しい「抗線維化療法」が実現できる可能性がある 。
科学の探求は、こうして病態の根源を一つ一つ解き明かし、未来の医療へと繋がっていく。実にエキサイティングな研究じゃったな。
それでは、また次の機会に。キツネ博士じゃった。


コメント